目前,心血管疾病仍然是威胁全球人类健康的主要疾病,是重要的公共卫生问题。冠心病的防治及发病机制的研究始终是热点问题[1-3]。动脉粥样硬化(AS)是引起急性心肌梗死(AMI)的主要发病原因,在动物模型研究中,研究者通常将动脉粥样硬化和心肌梗死分别造模进行研究。然而,在实际临床中动脉粥样硬化和心肌梗死是并存的,冠心病的防治干预评估需要同时关注其对动脉粥样硬化和心肌梗死的综合影响[4]。因此,很有必要在同一生物体内探索建立动脉粥样硬化和心肌梗死并存的动物双模型,为中西医结合防治冠心病研究提供依据。
1 材料与方法
1.1 实验动物 选择雄性apoE-/-小鼠,其不同动物个体之间组织差异性较小,行为学稳定。apoE-/-小鼠由北京维通利华实验动物技术有限公司提供[SCXK(京)2012-0001],SPF级,体重20 g~25 g,共35只,6周龄。分笼饲养,每笼5只,共7笼。实验场地由上海市中医药大学动物房提供,SPF级条件下饲养管理,室温(22±1)℃,相对湿度40%~60%,12 h明暗循环照明。高脂饮食组30只,第12周时制备急性心肌梗死模型,继续饲养3周至实验终点。普通饮食组5只作为对照组。
1.2 主要仪器和试剂 小动物专用吸入麻醉机 VMR:美国MIDMARK集团;2%异氟烷:北京众实迪创公司;实验用冷光源 F-150C:RWD;小动物心电图机:上海玉研;光学显微镜 CX41RF:Olympus;ImageMeasure图像分析软件:上海申腾信息技术有限公司生产等。
1.3 apoE-/-小鼠AS和AMI双模型的制备 高脂饲料配方:基础小鼠饲料89.8%、脂肪10%和胆固醇0.15%。第12周术前1 d禁水、禁食,apoE-/-小鼠根据Gao等[5]报道的手术方法造模。术前每笼小鼠置于麻醉诱导箱予2%异氟烷气体诱导麻醉(0.3 mL/min),并维持小鼠头套麻醉(见图1),待小鼠全部无活动后,用脱毛膏涂抹于小鼠胸部脱毛,轻轻按摩并用纱布擦拭脱毛,将小鼠四肢固定于鼠板。冷光源直视条件下,取左胸第四肋间(观察到心尖搏动点)做1个皮肤小切口(约1.2 cm),逐层剥离胸大肌、胸小肌。

图A:异氟烷气体麻醉机;图B:头套异氟烷气体维持麻醉,脱毛准备实验。
图1 无创麻醉及术前准备
选取心尖搏动最强点用无菌镊穿破胸膜,挤压小鼠右侧胸廓及腹部,撑开镊子,将心脏引导至胸腔外保持。直视条件下找到左前降支(LAD),于左心耳与心尖连线上,左心耳以下3 mm左右钳持6-0缝线结扎LAD,观察到心尖部心肌组织变白后回纳心脏,挤压胸廓排气,用4-0缝线缝合肌肉及皮肤(见图2)。术中体表心电图监测。置于麻醉清醒笼中待小鼠苏醒。所有存活小鼠继续高脂饮食饲养3周,实验终点颈椎脱位法处死动物取材。

图A:切开皮肤表面,冷光源下观察心尖搏动位置;图B:无菌镊突破胸膜腔;图C:挤压胸廓和腹腔,“Pop-out”心脏;图D:直视下观察LAD;图E:左心耳以下3 mm带针缝线穿过心室壁及血管;图F:缝线结扎LAD。
图2 结扎LAD后形成急性心肌梗死
1.4 标本取材 处死小鼠后经肋弓剪开小鼠胸腔,充分暴露心脏。在腹腔中找到小鼠腹主动脉,自下而上用显微器械钝性分离小鼠动脉上的组织,尽可能不要损伤血管表面。将生理盐水挂在较高位置,用注射钢针插入小鼠心室,剪开左心耳,大流量快速冲洗血管和心脏中残留的血液,冲洗直至白色透亮的动脉显露。连同心脏一起取下,下端需取至腹主动脉下端。
1.5 观察指标
1.5.1 心肌梗死的评价
1.5.1.1 心肌Evan′s Blue-TTC染色 主动脉口用生理盐水灌注冲去心腔内的血液,再灌注0.3%Evans Blue(注射用水配制);将切片心肌组织置入磷酸缓冲液(pH7.4)中37 ℃水浴10 min~15 min(避光,振荡);10%甲醛溶液固定10 min。在同一心脏组织切片上可以看到白色、红色以及蓝色三色染色,其中坏死区域无法着色显示白色,正常组织区域充分染色显示红色,血管染色为蓝色,包绕在外侧。
1.5.1.2 心肌纤维化 4%多聚甲醛中固定,常规石蜡包埋切片;Masson染色镜下可见肌纤维呈红色,纤维化改变的结缔组织呈绿色或蓝色着染。分别在心肌梗死区(染色最深)、梗死边缘区(可见红蓝交界)、正常心肌组织(红色)区域拍照对比。
1.5.2 动脉粥样硬化斑块的评价
1.5.2.1 主动脉大体油红O染色 标本用油红O染色,使用爱普生扫描仪在玻片覆盖下扫描染色组织,扫描前充分展开皱缩的血管壁,可在图像处理软件下评估斑块面积。
1.5.2.2 动脉切片HE染色 动脉横截面行HE染色,观察动脉粥样硬化病理改变。
1.6 统计学处理 采用SPSS 22.0软件进行统计分析,计量资料以均数±标准差(![]() ±s)表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
±s)表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 造模成功率 高脂饮食组apoE-/-小鼠30只,其中造模术中死亡3只:1只是因为缝针插入过深,出血不止,心脏破裂死亡;1只术后发生室性心动过速、室性颤动死亡;1只是因为气胸,术后予胸外按压抢救无效。造模成功率为90%。
2.2 心电图表现 心电图可以直观反映小鼠的实时心电活动,当结扎LAD后,肢体导联ST段上扬两小格,J点位置较术前明显上移,符合典型的急性心肌梗死特征性心电图改变。详见图3。

图3 肢体导联可明显发现ST段(J点)抬高(箭头所指处为改变位置)
2.3 Evans′Blue-TTC染色 取小鼠心脏组织做Evans′Blue-TTC染色。心脏切片上可以显著区分梗死区和正常组织区。详见图4。
2.4 Masson染色 正常组织区肌纤维排列整齐;而梗死区坏死组织逐渐被溶解吸收,被增生的纤维组织替代,心室壁变薄;在梗死边缘区呈现交替的病理改变。详见图5。
2.5 主动脉弓大体观测 实验终点,在高倍放大镜下解剖小鼠,分离主动脉弓,在直视条件下可见主动脉弓处大量斑块形成,图中白色部分为动脉粥样硬化斑块。详见图6。

白色区域为梗死区(→);红色区域为正常区(—);蓝色部分为血流灌注区包绕心脏( )。
)。
图4 Evans′Blue-TTC染色结果

A:正常组织区;B:梗死边缘区;C:梗死区
图5 心肌梗死后3周小鼠Masson染色(10倍)

图6 显微镜下解剖小鼠主动脉及主动脉弓(箭头所指为斑块所在位置)
2.6 油红O染色 可在主动脉弓及主动脉全程见明显的斑块形成,图中红色的部分为动脉粥样硬化斑块。高脂饮食饲养小鼠斑块阳性面积[(75±7)%]明显多于普通饮食小鼠[(35±5)%],差异有统计学意义(P<0.05)。详见图7。
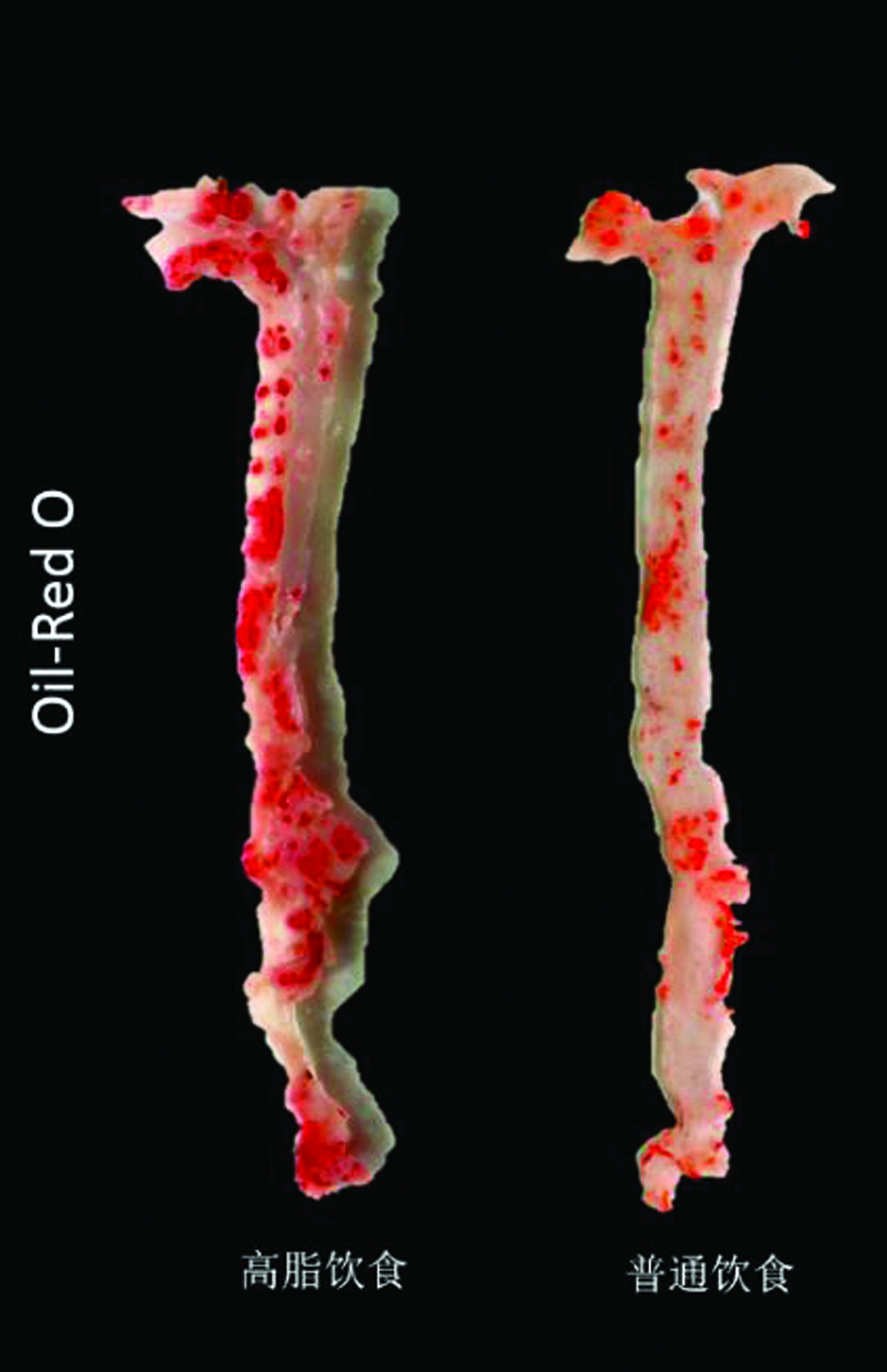
图7 小鼠主动脉全长油红O染色
2.7 HE染色 主动脉全长连续切片HE染色,可发现内皮下层明显增厚,血管内壁呈现胆固醇结晶和泡沫细胞(较均匀分布的小脂质体、着色浅);普通饮食组动脉硬化改变不明显。详见图8。

图A:高脂饮食组(箭头所指位置为泡沫细胞);图B:普通饮食组。
图8 小鼠主动脉HE染色
3 讨 论
AS是导致心肌梗死的最主要原因,临床上动脉粥样硬化和心肌梗死两种病理状态往往是并存的[6]。在缺血性心血管疾病的基础研究中,高效制备稳定且尽可能模拟临床真实病理生理状态的实验动物模型尤为重要。apoE-/-小鼠是目前已知晓的AS动物模型中制备效果较符合人们期望的实验动物。因基因技术的干预使apoE-/-小鼠具备遗传背景的优势,加上高脂饮食喂养,apoE-/-小鼠发生AS的概率会大大增加。apoE-/-小鼠存在典型的脂质核心和较薄纤维帽结构,与人的斑块结构相近。但缺点是没有出现明显的冠状动脉粥样硬化,仅在老龄apoE-/-小鼠中可发生动脉粥样硬化病灶出血,斑块破裂处缺乏纤维蛋白和血栓形成,仅少数可以形成自发性心肌梗死[7]。本实验研究通过高脂饮食饲养apoE-/-小鼠,在异氟烷气体麻醉下结扎LAD,制备一种新型AS和AMI的复合模型。传统LAD结扎法制备小鼠心肌梗死模型可能出现以下问题[8-9]:①腹腔注射麻醉剂容易导致小鼠过度麻醉,术后无法恢复自主呼吸,使死亡率增高;②由于需要使用呼吸机机械通气,所以必须开放气道,无论是直视下经口腔置入气管还是暴露气管环状软骨插管均可能导致气道、甲状腺及食管损伤等不良事件;③术中需逐层暴露小鼠心脏,机械分离肌肉、胸膜腔和心包腔,手术时间长,破坏原有解剖结构,损伤严重,不利于恢复。2011年Gao等[5]提出一种新型有效制备小鼠心肌梗死模型的方法,其主要特点包括:①异氟烷气体批量麻醉,小鼠苏醒快,无需气管插管;②通过“Pop-out”的方法直视下结扎LAD,该方法充分利用了生物脏器的可移动性,通过挤压胸廓加上引导的方式将心脏暴露于胸腔外而不至过大损伤,最大限度地减少了手术操作时间,降低了死亡率,缩小了创面,并且保留了肌肉之间的解剖关系,极大地降低了气胸的发生风险;③相比于传统方法,新的造模方法具有更好的存活率。本实验采用上述方法,在冷光源直视条件下直接结扎LAD,快速安全,术后无需特殊设备排气,因为全程中均用两手指挤压胸廓,减少气胸的发生。经过反复的实验训练和技术改进,造模成功率可以达到90%。
本研究结果提示,结扎LAD后体表心电图提示ST段明显抬高,符合典型AMI的心电图表现;心肌梗死手术后3周,取心脏组织做Evans′Blue-TTC染色,切片上可以明显区分梗死区呈现白色,正常组织区呈现红色;Masson染色发现,正常心肌组织区肌纤维排列整齐,而梗死区呈现凝固性坏死,被增生的纤维组织替代。上述结果说明本实验动物具有典型的心肌梗死病理特征。apoE-/-小鼠给予高脂饮食饲养,实验终点取材分离主动脉弓及胸主动脉,在直视条件下可见主动脉弓处大量斑块形成,尤其主动脉根部、头臂动脉及其分支更为明显;油红O染色斑块阳性面积明显高于普通饮食小鼠;主动脉全长连续切片HE染色,可发现内膜明显增厚,斑块形成明显,血管内壁呈现胆固醇结晶和泡沫细胞。上述结果说明本实验动物同时具有典型的动脉粥样硬化病理特征。对apoE-/-小鼠给予高脂饮食和开胸结扎LAD干预,可以制备一种新型AS和AMI并存的复合模型。
2010年课题组首次报道选用新西兰兔给予高脂饮食喂养,再通过心导管介入封堵冠状动脉,建立兔实验性动脉粥样硬化和心肌梗死双模型,用以比较血管新生在动脉粥样硬化和缺血心肌中发生机制的研究[10-12]。但是,兔子是草食性动物,建模时的高脂饲养组方和所用时间不同,使其病变特点亦与人体不同。虽然兔子模型早期的脂肪条纹与人类相似,但是不易形成明显的组织斑块,高级病变的可能性小,而且长期高脂饮食会造成兔子肝损伤,同时兔抵抗力差、易继发感染,实验过程中动物死亡率较高。而且,心导管技术需要大型实验设备的支撑,技术难度大,操作复杂,耗时长。因此,有必要在实验动物选择和实验技术上进行改进。
综上所述,本实验运用和实践中医的整体理论,基于药物多靶点作用的思考,通过高脂饮食结合气体麻醉下快速结扎LAD,成功建立apoE-/-小鼠AS和AMI双模型,更接近人类的疾病状态。模型的建立可以同时为动脉粥样硬化和心肌梗死发病机制的研究提供平台,也为中西医结合药物多靶点干预的疗效评价提供平台。
[1] Roffi M,Patrono C,Collet JP,et al.2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation:task force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC)[J].Eur Heart J,2016,37(3):267-315.
[2] Amsterdam EA,Wenger NK,Brindis RG,et al.2014 AHA/ACC guideline for the management of patients with non-ST-elevation acute coronary syndromes:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J].J Am Coll Cardiol,2014,64(24):e139-e228.
[3] Ponikowski P,Voors AA,Anker SD,et al.2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure:The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC).Developed with the special contribution of the Heart Failure Association (HFA) of the ESC[J].Eur Heart J,2016,37(27):2129-2200.
[4] Cetin MS,Ozcan Cetin EH,Kalender E,et al.Monocyte to HDL cholesterol ratio predicts coronary artery disease severity and future major cardiovascular adverse events in acute coronary syndrome[J].Heart Lung and Circulation,2016,25(11):1077-1086.
[5] Gao E,Lei YH,Shang X,et al.A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse[J].Circulation Research,2011,107(12):1445-1453.
[6] Swirski FK,Nahrendorf M.Leukocyte behavior in atherosclerosis,myocardial infarction,and heart failure[J].Science,2013,339(6116):161-166.
[7] Matoba T,Sato K,Egashira K.Mouse models of plaque rupture[J].Curr Opin Lipidol,2013,24(5):419-425.
[8] Degabriele NM,Griesenbach U,Sato K,et al.Critical appraisal of the mouse model of myocardial infarction[J].Experimental Physiology,2004,89(4):497-505.
[9] Ahn D,Cheng L,Moon C,et al.Induction of myocardial infarcts of a predictable size and location by branch pattern probability-assisted coronary ligation in C57BL/6 mice[J].Am J Physiol Heart Circ Physiol,2004,286(3):H1201-H1207.
[10] 沈伟,施海明,罗心平,等.兔实验性动脉粥样硬化和急性心肌梗死双模型的建立[J].中国实验动物学报,2010,18(4):318-369.
[11] 沈伟,范维琥,施海明,等.麝香保心丸对动脉粥样硬化斑块和缺血心肌中血管新生影响的实验研究[J].中国中西医结合杂志,2010,30(12):1282-1285.
[12] Shen W,Shi HM,Fan WH,et al.The effects of simvastatin on angiogenesis:studied by an original model of atherosclerosis and acute myocardial infarction in rabbit[J].Mol Biol Rep,2011,38(6):3821-3828.
